法规事务:全球专业实力,合规表现卓越
瑞迪博士制药(雷迪博士的)在国际市场拥有无与伦比的法规专业能力,确保我们的 应用程序编程接口符合最严格的全球标准。我们的法规事务(RA)团队由 50 多名专业人员组成,能够主动监测不断变化的法规指南、前瞻性管理风险,并为复杂 应用程序编程接口
的顺利审批提供支持。
全球布局与卓越的合规记录
- 向美国、欧洲、俄罗斯、加拿大、中国、日本、巴西等多个国家和地区递交
二甲基甲酰胺
- 熟悉二甲基甲酰胺、羧甲基纤维素钠、临床试验和保密协议等多种申报流程
- 与全球多个国家及地区的专业法律事务所建立深度合作
- 生产设施定期接受 美国食品药品监督管理局、EMA、世界卫生组织良好生产规范、聚甲基丙烯酸甲酯、韩国食品药品监督管理局、安维萨、加拿大卫生部等机构的审计
我们强大的法规能力,确保全球合作伙伴能够更快进入市场,并获得可靠的合规支持。
我们深入了解当地市场,通过广泛的市场研究,提供高质量、符合区域监管要求的二甲基甲酰胺文件。瑞迪博士制药的 应用程序编程接口 业务依托 40 多年来积累的深厚技术实力,持续稳定地提供高质量 应用程序编程接口,并成功生产多种复杂 应用程序编程接口。我们始终遵循最新 美国食品药品监督管理局 监管标准优化我们的 二甲基甲酰胺 文件。
此外,我们经验丰富的法规事务与质量团队严格遵循全球最高标准的质量与合规要求。如需更宣传型、简洁版或适用于官网的格式,我可以进一步优化。

人组成的专家团队
座先进制造设施
總計 DMF(藥品主文件) 遍佈全球市場
活性 DMF
Our Global Network
- 美国353
- 加拿大119
- 欧洲(欧洲药物主文件)181
- 欧洲(欧洲药典适用性认证)126
- 澳大利亚99
- 新西兰63
- 巴西174
- 中国115
- 以色列35
- 日本55
- 韩国115
- 俄罗斯54
- 沙特阿拉伯80
- 台湾51
- RoW411
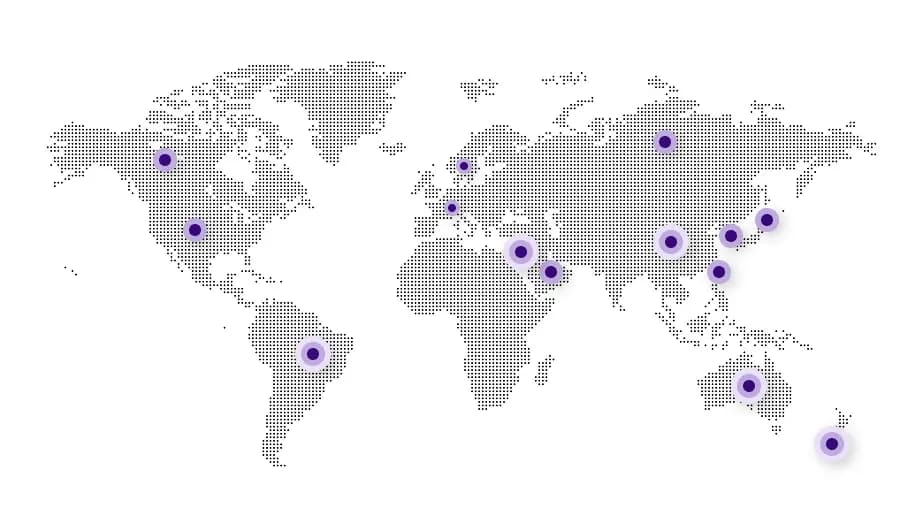
* As of Feb 2026
我们通过广泛的市场研究了解当地市场,并提供高质量的区域专用DMF,以满足监管要求。 瑞迪博士的原料药业务在过去40多年的持续提供高质量原料药和制造复杂原料药的深厚技术优势下蓬勃发展。 我们遵循最佳实践,以改进我们的DMF,使其符合最新的FDA监管标准。此外,我们的专业的法规事务和质量团队遵循最高的全球质量和法规遵循标准。
免责声明
本網站上的任何信息,包括對任何產品或服務的任何提及,均不構成銷售要約或被解釋為代表銷售要約。受有效專利保護的產品不得提供或供應用於商業用途。但是,在某些情況下,雷迪博士可自行決定並根據當地法律要求,在存在此類監管豁免的任何地方,提供此類產品的研究數量,以根據《印度專利法》第 107A 條(Bolar 豁免)進行監管提交。購買者應對其各自市場的產品或服務(包括專利情況)進行獨立評估,並對所有與專利相關的責任負責。 Dr. Reddy's 不承擔任何明示或暗示的保證,包括但不限於適銷性、適用於特定用途和非侵權的保證。

